Malacok új funkcióval
Ha gyerekének autóbalesetben úgy megsérülne a mája, hogy már nem tudják megmenteni, és hirtelen szervdonor sem akadna – nem szokott –, az egyetlen megoldást pedig egy genetikailag módosított disznó szerve jelentené, hogyan döntene? Sertésbőrt és -szívbillentyűt már régóta ültetnek emberbe, de mi a helyzet a komolyabb belső szervekkel? A génszerkesztés adhat új lendületet a kutatásoknak.
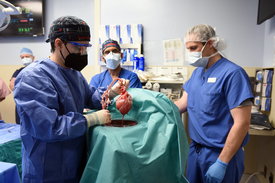
A xenotranszplantációval, vagyis a különböző fajok közötti sejt-, szövet- vagy szervátültetéssel évszázadok óta kísérletezik az emberiség, de bonyolultabb szervvel eddig nem sikerült eredményt felmutatni. Most azonban a Marylandi Egyetem klinikáján génszerkesztett sertésszívet kapott egy beteg. Életét másként nem lehetett volna megmenteni, olyan mértékben leromlott az egészségi állapota, hogy esélye sem lett volna emberi szívhez jutnia. „Választhattam, hogy meghalok, vagy beleegyezem ebbe az átültetésbe. Én élni akarok” – mondta a műtét előtt az 57 éves David Bennett. A hétórás beavatkozás után most még gépekre csatlakoztatva fekszik, de már magától lélegzik. Az elkövetkező hetekben derül ki, hogy hosszú távon is működik-e a szervezetében a szerv. Az eddigi állatszív-beültetések után a betegek csak pár óráig éltek, Bennett viszont egyelőre jól van. Ha teljesen felépül, az hatalmas áttörés lesz a xenotranszplantációban. Ha nem, valószínűleg próbálkoznak még a kutatók.
Az Egyesült Államokban naponta 17 beteg hal meg új szervre várva. Sok a halálos szívfejlődési rendellenességgel születő gyerek is, és az átlagosan három hónapos várakozási idő alatt a babák fele meghal. Az új szívre váró felnőttek ma már hozzájuthatnak ideiglenes megoldásként műszívhez, de az újszülöttek nem. Már az is sokat jelentene, ha egy disznószív ideiglenesen életben tartaná őket.
A sikeres xenotranszplantáció nem újdonság: Magyarországon például 1968-ban ültettek be először sertésből származó szívbillentyűt egy 17 éves fiú szervezetébe. Az ilyen típusú műtétek azóta megszokottá váltak, akárcsak a sertésbőr átültetése égési sérülések kezelésére. Ám a bonyolultabb szervek eddig mindig kilökődtek. Számos próbálkozás történt az idők során, az egyik legismertebb ilyen egy csecsemő esete 1984-ből, aki egy pávián szívét kapta meg, hogy életben tartsák, míg nem találnak számára emberi szervet. 21 napig élt vele, végül nem tudta befogadni a majomszívet a szervezete.
A génmódosítással azonban lehetőségek tárháza nyílt meg a kutatók előtt. Pár éve a müncheni egyetemen úgy módosítottak disznószívet, hogy ne lökődjön ki majmok szervezetéből. A kísérletben az egyik páviánt 195 napig tudták életben tartani. A Revivicor nevű vállalat pedig az alfa-gal nevű cukorral szemben fellépő emberi immunválasz kiiktatására állt rá. Ez a kilökődési folyamatoknak az egyik legfőbb motorja. Az alfa-gal (a galaktóz-alfa-1,3-galaktóz nevű cukor – a szerk.) minden emlősben megtalálható, kivéve néhány főemlőst és az embert. Az erekben van, ezért okoz problémát a nagyobb szervek transzpalntációjakor, míg a kisebb „alkatrészek” beültetésénél nem jelentkezik ilyen. Egyébként egy különös vöröshús-allergiáért is felel, amelyet a magányos csillag nevű kullancs okoz. Csípésével alfa-gal cukrot juttat az emberi szervezetbe, olyan immunválaszt kiváltva, amely később allergiás reakciót idéz elő a marha-, sertés- vagy bárányhúsra.
A Revivicornak már 2003-ban sikerült kiiktatnia disznóban az alfa-gal termeléséért felelős gént. Az eljárásnak köszönhetően aztán nemcsak gyógyászati felhasználásra kezdett sertést tenyészteni, hanem fogyasztási céllal is, allergiásoknak. Az ily módon manipulált szervezetű állatok forgalomba hozatalát az amerikai Élelmiszer- és Gyógyszerfelügyeleti Hivatal (FDA) 2020 decemberében engedélyezte.
A cég száz sertést nevel iowai telephelyén, ezeket donornak szánják. Az első innen származó sertésvesét tavaly októberben tesztelték emberen. Egyelőre agyhalott pácienssel hajtottak végre kísérletet. Ilyenkor a halál már beállt, de a szervek működését mesterségesen fenntartják. Az illető érhálózatára kötötték rá kívülről a vesét, két napra. A műtét után a szerv azonnal működésbe lépett, és a teszt időtartama alatt megfelelően látta el feladatát, vagyis tisztította a szervezetet a méreganyagoktól, vizeletet termelt, miközben a kilökődés nem kezdődött meg. A második ehhez hasonló vizsgálatot decemberben végezték, szintén külsőleg kötve az érrendszerre egy génszerkesztett disznóvesét, 54 órára.
Ezután kapott vészhelyzeti engedélyt az FDA-tól a Marylandi Egyetem a sertésszív beültetésére, azzal az indokkal, hogy ellenkező esetben a páciens meghalt volna. Az érintett állati szívet nemcsak az alfa-gal cukor előállításáért felelős gének eltávolításával módosították, hanem CRISPR-módszerrel (lásd keretes írásunkat) hat emberi gént is elhelyeztek benne, amelyek a kilökődés valószínűségét csökkentették, valamint egy gén kiiktatásával megakadályozták azt is, hogy túl nagyra nőjön a szerv. A beteg emellett egy újfajta gyógyszert is kapott a hagyományos immunszupresszánsok mellé, ez még szintén tesztfázisban van.
A xenotranszplantáció mérföldkövei
1682-ben egy kutyából származó csontot használtak fel egy orosz nemes sérült koponyájának javítására. Az operáció sikeres volt, de kiváltotta az egyház haragját.
1963–64-ben csimpánzokból származó vesékkel kísérleteztek, amelyeket 12 beteg kapott meg az Egyesült Államokban. A legtöbben két hónapon belül meghaltak, egyikük 9 hónapig maradt életben a szerv kilökődése nélkül.
1964-ben egy 68 éves emberbe egy csimpánz szívét ültették át, két óráig maradt életben.
1969 és 1974 között három gyerek kapott csimpánzmájat, 1–14 napot éltek.
1977-ben egy 25 éves asszonyba páviánszívet ültettek, ám a kilökődésig mindössze hat óra telt el.
1984-ben egy újszülött kapott páviánszívet Kaliforniában, 21 napig élt.
1992-ben egy pávián máját ültették be a betegbe, aki 71 nap után agyvérzésben halt meg, de a szerv nem lökődött ki.
1992-ben sertésből származó májat ültettek át két betegbe, hogy életben tartsák őket, amíg emberi szervet nem találnak. 32 óra múlva haltak meg.
Annak, hogy sertést választottak xenotranszplantációs célokra, nem csak a genetikai hasonlóság az oka, hiszen a főemlősök jóval közelebb állnak az emberhez. Ám utóbbiak donorkénti tenyésztése számos állatetikai kérdést vetne fel. A sertés pedig eleve haszonállat, ráadásul akár nyolc hónap alatt ivaréretté válik, így viszonylag gyorsan hozzá lehet jutni az átültetéshez szükséges szervekhez.
Az amerikai eGenesis és a kínai Qihan Bio biotechnológiai cég is folytatott kutatásokat sertésszervekkel, ők két tucat gén átszabásával módosították és vizsgálták laboratóriumban az immunválaszt. De nem csak szervekről van szó, hiszen például az egyes típusú cukorbetegség kezeléséhez szükséges inzulintermelő hasnyálmirigysejteket vagy épp szaruhártyát is lehetne ily módon nyerni.
Persze még nagyon sok a megválaszolandó kérdés. A legfőbb közülük: tud-e vajon hosszú távon megbízhatóan működni egy állati szerv emberi testben, illetve nem kerülhetnek-e át vele állati eredetű betegségek az emberi szervezetbe? Az mindenesetre már látszik, hogy nem lehetetlen megoldani a felmerülő problémákat, és ha Bennett szervezete mégis kilökné a sertésszívet, úgy tűnik, a kutatók tovább fognak próbálkozni. A CRISPR-módszer rengeteg lehetőséget rejt magában.
A génszerkesztés
A baktériumokban előforduló CRISPR-/Cas-rendszert 1987-ben fedezték fel. Ezek olyan szakaszok a baktériumok DNS-ében, amelyek megegyeznek az őket megtámadó vírusok egyes DNS-szakaszaival: a baktérium semlegesíteni tudja a vírust úgy, hogy az érintett szakaszokból átíródik egy irányító RNS, összeáll a Cas9 nevű DNS-elvágó enzimmel, megkeresi az egyező részt a vírus DNS-én, és elvágja. A baktérium így szétdarabolja, vagyis semlegesíti az ellene támadó vírust. Ezt használták fel CRISPR-módszeren alapuló génszerkesztéshez: mesterséges irányító RNS-sel bármilyen DNS-szakaszt meg lehet keresni (például egy genetikai betegséget okozó részt), odavitetni vele a Cas9-et: a vágással tönkre is tehetjük az érintett részt, de fel is ajánlhatunk a sejtnek egy új genetikai információt.
Több kutatócsoport majdnem egyszerre fejlesztette ki az eljárást 2013 elején, ezért sokáig vita tárgya volt, kié legyen az elsőbbség. 2020-ban a francia Emmanuelle Charpentier és az amerikai Jennifer A. Doudna kapta érte a kémai Nobel-díjat. Korábban is létezett génszerkesztés, de ez sokkal pontosabb és olcsóbb eljárás. Óriási a jelentősége genetikai és vírusos betegségek, továbbá a rák gyógyításában is.